constituye aproximadamente el 50% en masa de la corteza terrestre y forma el 21% en volumen de la atmósfera; es componente activo del aire, se encuentra presente en el agua y como óxidos con otros elementos.
Reacciona tanto con metales como con no metales y, entre los no metales es el segundo en reactividad química, después del flúor.
Un ejemplo de las reacciones del oxígeno con un metal, es la que ocurre con el magnesio al someterlo a la reacción de oxidación en una flama, pues desprende una intensa luz blanca y se convierte en un sólido blanco muy frágil; el producto de esta reacción es un óxido metálico llamado óxido de magnesio.
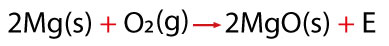
- bata
- guantes
- lentes
- trapo
- no jugar
- no comer
- agua
- no telefonos
ejercicio 3
verificacion
obtencion de oxidos
La nomenclatura química es un conjunto de reglas que se aplican para nombrar y representar con símbolos y fórmulas a los elementos y compuestos químicos. Actualmente se aceptan tres sistemas de nomenclatura donde se agrupan y nombran a los compuestos inorgánicos:
- Sistema de nomenclatura estequimétrico ó sistemático de la Unión Internacional de Química Pura y Aplicada, (IUPAC).
- Sistema de nomenclatura funcional, clásico ó tradicional.
- Sistema de nomenclatura Stock.
- oxidos metalicos Resultan de la combinación del oxígeno con metales y al reaccionar con el agua producen base
- oxidos acidos Son combinaciones del oxígeno con un no metal y al reaccionar con agua producen ácidos del tipo oxiácido.
- hidroxidos Una de las principales aplicaciones de las bases o hidróxidos es en la fabricación de los jabones que usamos a diario en casa.
- acidos uando se tiene un óxido no metálico, al combinarse con agua forma un ácido de tipo oxiácido, se llaman oxiácidos porque en su composición está presente el oxígeno y la calidad ácida será determinada por la presencia del hidrógeno
- hidracido Este tipo de compuestos se forman con la combinación de un hidrógeno (H+) como ión positivo y un no metal (NM-) como ión negativo
NOMENCLATURA
(disculpe maestra lo intente muchas veces pero no me salio lo ques es nomenclatura y nomenclatura 2 perdon)
BALANCEO
El balanceo consiste en igualar el número de átomos de cada elemento tanto en los reactivos como en los productos, y sirve para verificar la Ley de la Conservación de la Materia (La materia no se crea ni se destruye solo se transforma).
Para escribir y balancear una ecuación química de manera correcta, es necesario tener presente las siguientes recomendaciones:
- Revisar que la ecuación química esté completa y correctamente escrita.
- Observar si se encuentra balanceada.
- Balancear primero los metales, los no metales y al final el oxígeno y el hidrógeno presentes en la ecuación química.
- Escribir los números requeridos como coeficiente al inicio de cada compuesto.
- Contar el número de átomos multiplicando el coeficiente con los respectivos subíndices de las fórmulas y sumar los átomos que estén de un mismo lado de la ecuación.
- Verificar el balanceo final y reajustar si es necesario.
ejercicio4
ejercicio 4
ULTIMA ACTIVIDAD
AHORCADO
MEMORAMA











